近日,我院林木遗传育种全国重点实验室安新民教授团队在杨树无痕编辑领域取得突破性进展,该研究创新性地构建了集可视化监测系统 (RUBY)、多基因编辑 (CRISPR/Cas9-sgRNAs)、外源 DNA清除系统(LoxP::FRT/FLP)的“三位一体”可视化无痕编辑系统 (Visual Monitoring DNA-Free Multi-Gene Editing System, VMDFGE),相关成果发表于Plant Biotechnology Journal(一区,Top期刊)。
CRISPR-Cas9系统已成为用于精准基因组编辑的强大“分子手术刀”,深刻变革了植物遗传与育种,推动了植物种质创新与品种改良。随着基因编辑技术的不断进步和完善,CRISPR/Cas9系统能够同时编辑多个基因。然而,解决基因编辑后残留编辑组件的问题、提高筛选效率以及建立一种稳定高效、不含外源转基因元件的基因编辑技术至关重要。
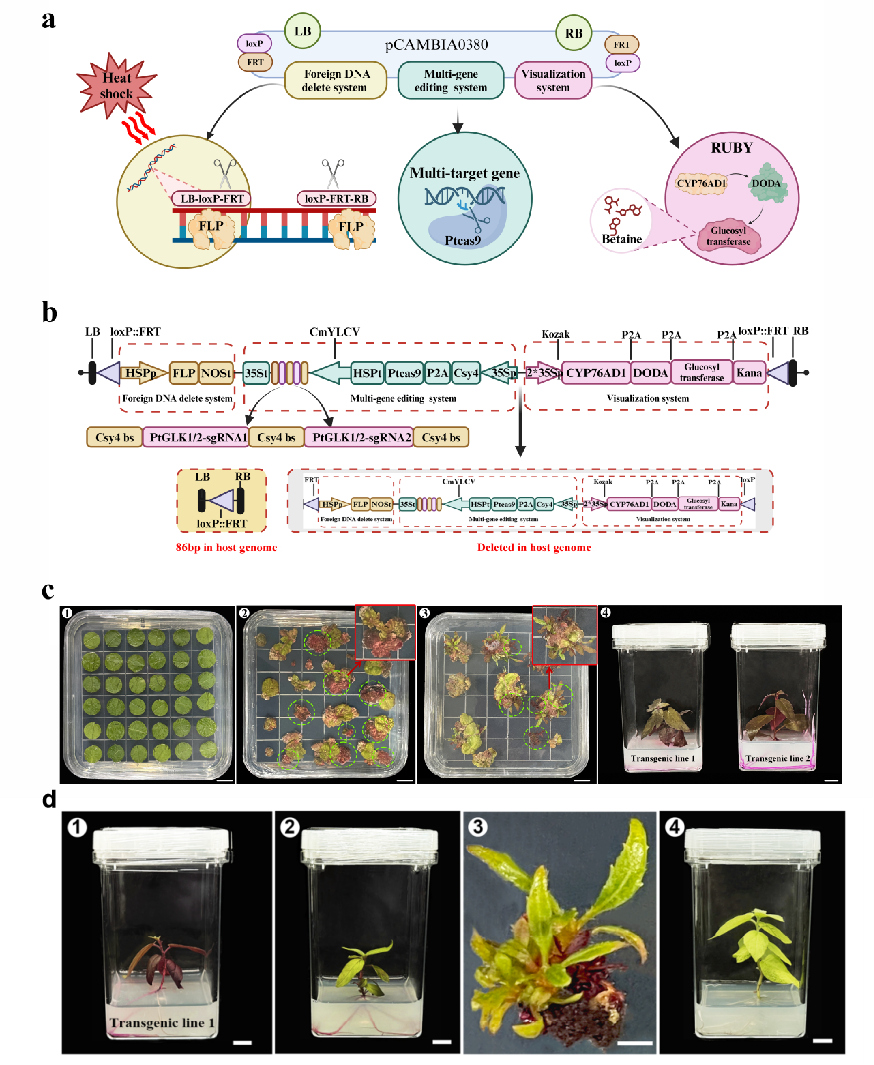
研究整合了三个系统:热诱导外源基因切除系统、多基因编辑系统和可视化系统。通过切除T-DNA border (TB)内的片段并重新设计对其进行修饰。在TB后1 bp处插入LoxP和FRT 重组位点,以利于中间序列的切除。重组酶系统设计使用HSP热诱导启动子进行温控启动,使元件能够从编辑后的转基因植物中移除。多基因编辑系统采用了CRISPR Cas9/Csy4 系统 (Csy4-Cleavable Cassettes),该系统对多基因编辑效率高,并对Cas9 蛋白序列进行了密码子优化。同时,可视化整合了RUBY系统,并添加了Kozak序列以增强RUBY基因表达和筛选效率。在适当的温度诱导下,FLP重组酶在识别位点切割基因组DNA,只留下‘LB-LoxP::FRT-RB’结构,而外源基因删除系统、基因编辑系统和可视化系统将从宿主基因组中被切除并降解代谢。
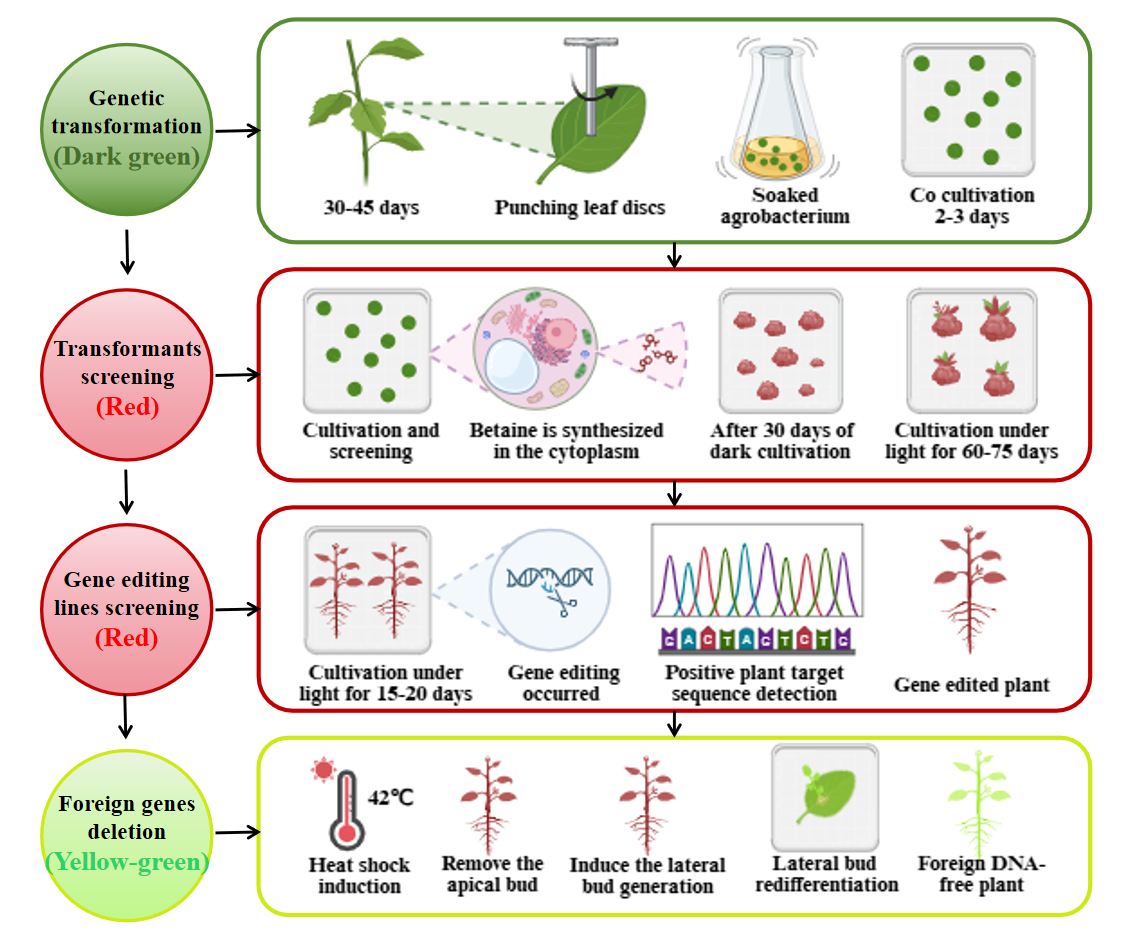
该研究最终在84K杨中实现了75.0%的可视化筛选效率、45.8%的多基因编辑率及54.5%的外源DNA切除效率。这一技术不仅攻克了传统CRISPR系统中脱靶效应、编辑元件及筛选标记残留的安全性难题,更为多年生木本植物提供了稳定的“编辑后无转基因痕迹”的分子育种新工具,有望推动基因编辑植物新品种监管批准和商业化进程。
北京林业大学生物科学与技术学院博士生吴茹茜为论文第一作者,北京林业大学生物科学与技术学院安新民教授与秦德彬讲师为该研究工作共同通讯作者。研究工作得到了国家重点研发计划、农业生物育种重大项目、国家自然科学基金、国家自然科学基金青年基金等项目的资助。
原文链接:https://doi.org/10.1111/pbi.70219
作者:秦德彬、安新民
审核:杜庆章

